过去十年里,CAR-T细胞疗法改变了肿瘤治疗领域的格局,尤其是在血液类肿瘤中展现出传统疗法无可比拟的治疗效果,为患者带来了新的希望。但这种前沿疗法对占据癌症大多数的实体瘤仍然效果不佳。
在实体瘤治疗中,CAR-T面临的一个关键挑战是,实体瘤的高度异质性、缺乏特异性抗原、T细胞浸润性差。而实体瘤上发现的肿瘤相关抗原(TAA)也在健康细胞和组织中表达,这导致针对肿瘤相关抗原的CAR-T疗法具有高风险的毒副作用。
CAR-T细胞需要进行大量的基因工程操作来靶向和浸润实体肿瘤,而细菌可以选择性地定殖在免疫特权的肿瘤核心,并优先在缺氧和坏死的肿瘤微环境中生长。近年来的一些研究表明,不同肿瘤类型普遍定殖有不同的肿瘤微生物群。有研究团队利用这一点,使用工程化细菌作为肿瘤内生物反应器,持续产生一系列有效载荷,从而导致肿瘤消退并减轻全身副作用。
2023年10月12日,哥伦比亚大学的研究人员在国际顶尖学术期刊 Science 上发表了题为:Probiotic-guided CAR-T cells for solid tumor targeting 的研究论文。
在这项研究中,研究团队将益生菌疗法与CAR-T细胞疗法相结合,创建了一个益生菌引导的CAR-T细胞平台——ProCAR,在这个平台上,T细胞被设计成感知和响应由实体肿瘤定植的益生菌递送的合成CAR抗原靶标,使CAR-T细胞能够原位发现、识别并摧毁肿瘤细胞。
体内临床前试验结果表明,这种ProCAR细胞治疗平台可以扩大CAR-T细胞治疗的范围,包括之前难以靶向的实体瘤。

在这项研究中,研究团队利用合成基因电路工程对一种已被很好表征的非致病性大肠杆菌菌株——E. coli Nissle 1917(EcN)进行改造,创造出了一种益生菌,该益生菌可以浸润并将合成的CAR靶标直接循环释放到实体肿瘤核心,有效地“标记”肿瘤组织。
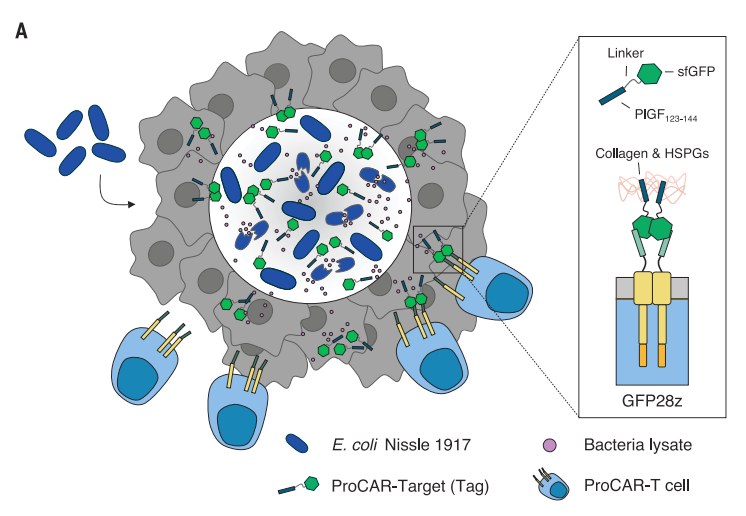
这些工程化的益生菌只在实体瘤肿瘤微环境(TME)中生长,并在生态位内达到临界密度时触发裂解事件,在原位循环释放遗传编码的有效载荷。然后,CAR-T细胞识别这些益生菌释放的抗原靶标,进而在原位杀死这些肿瘤细胞。此外,研究团队还设计了除了合成抗原靶标外还能释放趋化因子的益生菌,增强CAR-T细胞向肿瘤的募集,进一步提高治疗反应。
研究团队接下来在白血病、结直肠癌和乳腺癌的人源化和具有免疫功能的小鼠模型中测试了这种益生菌引导的CAR-T细胞平台的效果,结果显示,它可以安全地抑制肿瘤生长,减少肿瘤体积。
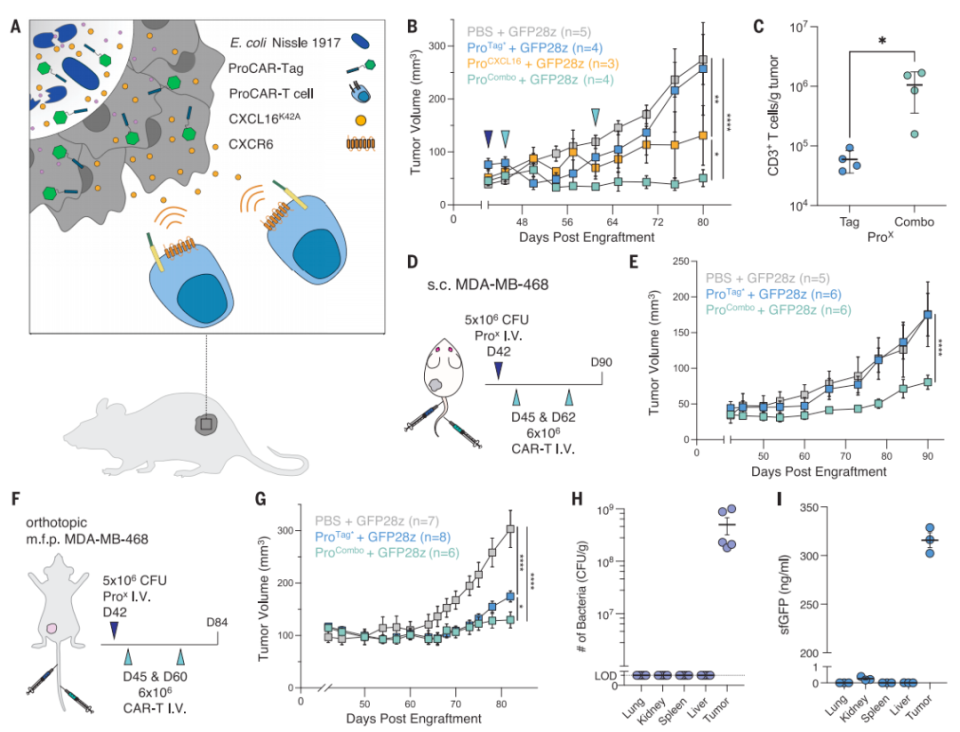
多功能益生菌产生肿瘤微环境调控因子的组合,促进全身递送,延缓原位乳腺肿瘤的生长
总的来说,这些研究数据表明,工程化益生菌可以在肿瘤微环境(TME)中选择性生长,并安全地原位释放能够增强CAR-T细胞治疗效果的有效载荷。这项研究提供了一个重要的概念验证,证明了益生菌引导的CAR-T细胞平台——ProCAR,是一种治疗异质性、冷肿瘤和低浸润性实体瘤的潜在方法。
来源于:上海科学领域达人